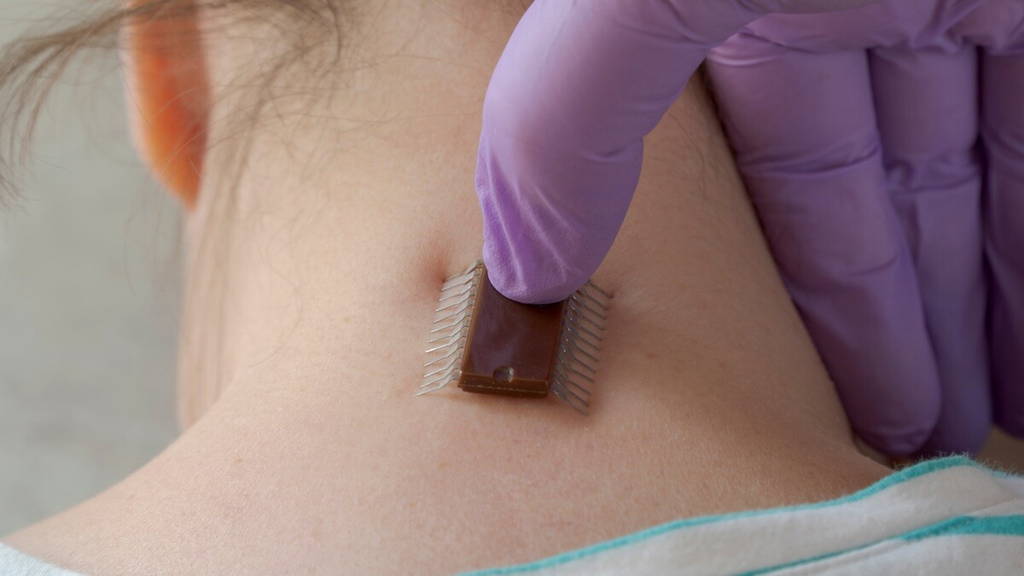
Amerikaanse onderzoekers hebben een bio-elektronisch implantaat ontwikkeld dat gekweekte alvleeskliercellen helpt om beter te rijpen en te functioneren. De technologie kan op termijn de basis vormen voor nieuwe, celgebaseerde behandelingen voor diabetes.
Door een ultradun, geleidend netwerk van draden te integreren in groeiend pancreasweefsel, creëerden de onderzoekers een hybride van levend weefsel en elektronica, door henzelf omschreven als een ‘cyborg’-organoïde. Volgens hoofdonderzoeker Juan Alvarez, PhD, is het concept minder futuristisch dan het klinkt.
“Wat we doen is vergelijkbaar met diepe hersenstimulatie,” stelt hij. “Net zoals een pacemaker het hartritme ondersteunt, kunnen gecontroleerde elektrische impulsen pancreascellen helpen zich correct te ontwikkelen en te functioneren.” Het onderzoek is een samenwerking tussen de Perelman School of Medicine at the University of Pennsylvania en de Harvard John A. Paulson School of Engineering and Applied Sciences. De resultaten zijn onlangs gepubliceerd in Science.
Tekort aan donorweefsel
Bij type 1-diabetes vernietigt het immuunsysteem de insulineproducerende eilandjes van Langerhans in de alvleesklier. In ernstige gevallen, en soms ook bij type 2-diabetesl, is transplantatie van een hele pancreas of losse eilandjescellen noodzakelijk. Donorweefsel is echter schaars en patiënten moeten levenslang immuunsuppressiva gebruiken om afstoting te voorkomen.
Lab-gekweekt pancreasweefsel kan deze beperkingen mogelijk omzeilen. Een belangrijk obstakel is echter dat gekweekte cellen zich buiten het lichaam vaak niet volledig ontwikkelen en minder betrouwbaar insuline afscheiden dan natuurlijke cellen.
Elektrische stimulatie
Om dit probleem aan te pakken, plaatste het onderzoeksteam een rekbaar, haarfijn elektronisch gaas tussen lagen ontwikkelende pancreascellen. Terwijl de cellen zich organiseerden tot eilandjesachtige structuren, kon het netwerk hun elektrische activiteit registreren en beïnvloeden.
Cruciaal was het nabootsen van een 24-uursritme, vergelijkbaar met het menselijke circadiane ritme dat onder meer slaap en stofwisseling reguleert. Eerder onderzoek van Alvarez toonde al aan dat dergelijke ritmische signalen onrijpe cellen kunnen stimuleren om zich volledig te differentiëren.
In deze studie bleek vier dagen van ritmische elektrische stimulatie voldoende om een blijvend activatiepatroon op gang te brengen. De eilandjescellen gingen hormonen op het juiste moment afscheiden en leken bovendien beter gecoördineerd samen te werken.
Slimme, zelfregulerende implantaten
De onderzoekers zien twee mogelijke toepassingen. In het eerste scenario worden gekweekte eilandjescellen vóór transplantatie elektrisch ‘getraind’, waarna zij zelfstandig insuline produceren. In een tweede scenario blijft het elektronische netwerk aanwezig in het lichaam, om de cellen te monitoren en zo nodig te stimuleren. Daarmee zou achteruitgang van functie, door bijvoorbeeld stress of ziekte, kunnen worden voorkomen.
Op termijn zou kunstmatige intelligentie een dergelijk systeem autonoom kunnen aansturen, met real-time monitoring en gerichte stimulatie zonder menselijke tussenkomst.
Hoewel klinische toepassing nog toekomstmuziek is, laat deze studie zien hoe regeneratieve geneeskunde en bio-elektronica steeds meer samenkomen. Voor de digitale gezondheidszorg markeert dit onderzoek een volgende stap in de ontwikkeling van ‘slimme’ weefseltherapieën: levende implantaten die niet alleen vervangen, maar ook actief ondersteunen en reguleren.
3D-geprinte eilandjes van Langerhans
Vorig jaar, tijdens het ESOT-congres, presenteerden onderzoekers een innovatieve 3D-bioprinttechnologie voor de behandeling van diabetes type 1. Met een speciaal ontwikkelde bio-inkt, gebaseerd op alginaat en gedecellulariseerd menselijk alvleesklierweefsel, printte het team functionele menselijke eilandjes van Langerhans. Deze insulineproducerende celclusters bleven tot drie weken stabiel en reageerden in het laboratorium adequaat op glucose door insuline af te geven.
Opvallend is de keuze voor onderhuidse implantatie in plaats van transplantatie in de lever, wat de ingreep minder invasief en potentieel veiliger maakt. Dankzij een poreuze structuur en geoptimaliseerde printinstellingen bleef meer dan 90 procent van de cellen levensvatbaar.
Het betrof een van de eerste studies met daadwerkelijk geprinte menselijke eilandjes. Vervolgonderzoek richt zich op diermodellen, cryopreservatie en alternatieve celbronnen, met als doel een breed toepasbare, gepersonaliseerde therapie te ontwikkelen die dagelijkse insuline-injecties mogelijk overbodig maakt.