Onderzoekers van de Amerikaanse National Institutes of Health (NIH) hebben een digitale replica ontwikkeld van cruciale oogcellen, waarmee zij op ongekend detailniveau kunnen bestuderen hoe deze cellen hun structuur en organisatie behouden, of juist verliezen bij ziekte. De zogenoemde digitale tweeling biedt nieuwe aanknopingspunten voor therapieontwikkeling bij onder meer leeftijdsgebonden maculadegeneratie (AMD), een van de belangrijkste oorzaken van slechtziendheid bij mensen boven de 50 jaar.
“Dit werk vertegenwoordigt de allereerste digitale tweeling op subcellulair niveau van een gedifferentieerde menselijke primaire cel,” zegt Kapil Bharti, Ph.D., wetenschappelijk directeur van het National Eye Institute (NEI) van de NIH. “Het laat zien hoe het oog een ideaal testbed is voor methoden die breder toepasbaar zijn binnen biomedisch onderzoek.” De studie is gepubliceerd in npj Artificial Intelligence.
Digitale kopie van RPE-cellen
De onderzoekers van de NIH richtten zich op retinale pigmentepitheelcellen (RPE-cellen). Deze cellen spelen een essentiële ondersteunende rol voor de lichtgevoelige fotoreceptoren in het netvlies. Ze recyclen dagelijks onderdelen van deze fotoreceptoren en zorgen voor de aanvoer van voedingsstoffen en zuurstof. Bij aandoeningen zoals AMD sterven RPE-cellen af, waarna ook fotoreceptoren verloren gaan en het zicht achteruitgaat.
Voor een goede werking moeten RPE-cellen een duidelijke ‘polarisatie’ hebben: een bovenkant (apicaal) die gericht is naar de fotoreceptoren en een onderkant (basaal) die contact maakt met de bloedvoorziening. Verstoring van die organisatie is een belangrijk kenmerk van ziekte.
AI analyseert miljoenen cellen
De digitale tweeling is opgebouwd op basis van RPE-cellen die bij het NEI zijn gekweekt uit geïnduceerde pluripotente stamcellen (iPS-cellen), ontwikkeld door het Allen Institute for Cell Science. Met behulp van geautomatiseerde confocale microscopie verzamelden de onderzoekers 3D-beelden van zo’n 1,3 miljoen cellen, afkomstig uit bijna 4.000 zichtbeelden.
Op basis van deze enorme dataset trainden zij een AI-algoritme met de naam POLARIS (polarity organization with learning-based analysis for RPE image segmentation). Dit algoritme herkent celstructuren zoals de celkern, organellen, vorm en volume, en volgt hoe deze zich in drie dimensies ontwikkelen. De analyse laat zien dat gezonde RPE-cellen een voorspelbaar ontwikkelpad volgen richting een goed gepolariseerde toestand. Afwijkingen van dit patroon kunnen nu nauwkeurig in kaart worden gebracht.
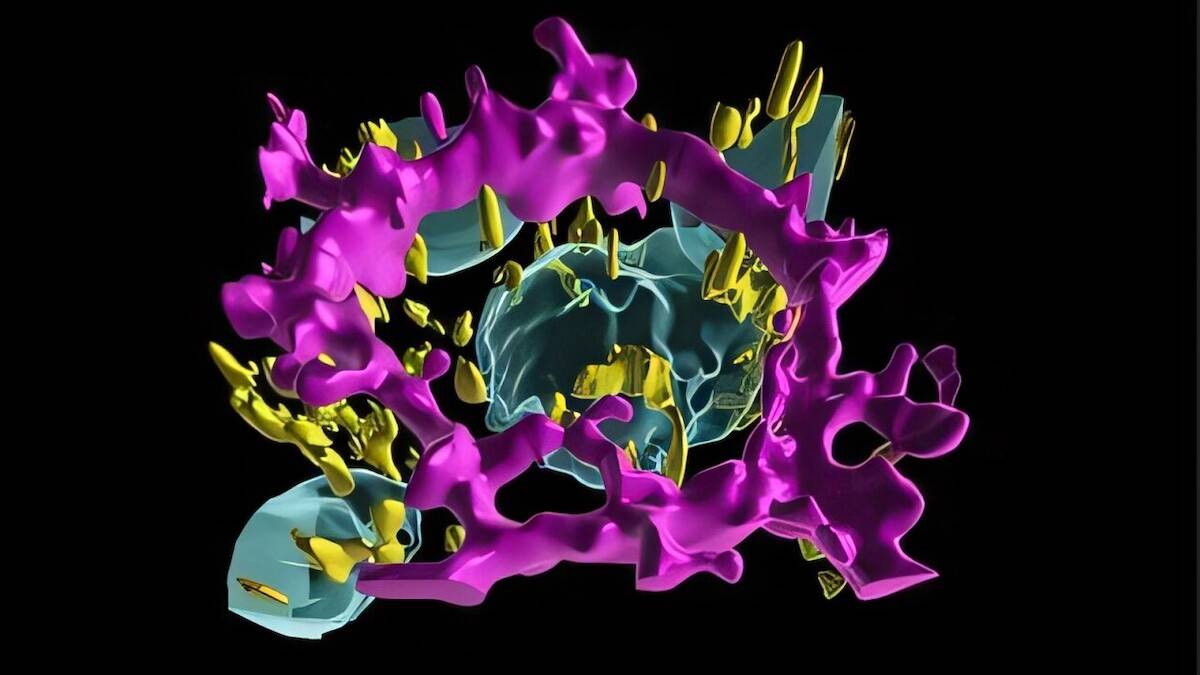
Nieuwe standaard voor therapieonderzoek
Het resultaat is een AI-gedreven atlas van gepolariseerde en niet-gepolariseerde RPE-cellen. Deze fungeert als referentiekader om te onderzoeken hoe ziekten zoals AMD de celorganisatie verstoren, tot op subcellulair niveau. “De digital twin-aanpak is een krachtig nieuw instrument voor de ontwikkeling van therapieën tegen AMD,” aldus Bharti. “Bovendien kan deze methode worden aangepast voor andere oogziekten en zelfs voor aandoeningen buiten het oog, waarbij celpolarisatie een rol speelt.”
Ook eerste auteur Davide Ortolan, Ph.D., NEI-onderzoeker, ziet brede potentie: “Door AI te combineren met wiskundige modellen hebben we een venster geopend op cellulaire processen die voorheen onzichtbaar waren. Deze technologie helpt ons niet alleen te begrijpen wat er misgaat bij AMD, maar biedt ook een platform om te ontdekken hoe we dat kunnen herstellen.”
Digitale tweeling innovaties
Het fenomeen van de digitale tweeling is in de zorg geen onbekende. De afgelopen jaren zijn diverse onderzoeken en voorbeelden van de meerwaarde van deze technologie voor het onderzoek en de diagnose naar verschillende aandoeningen de revue gepasseerd. Zo schreven we enkele weken geleden over een digitale tweeling die de stofwisseling van hersentumoren in kaart brengt en zo kan voorspellen welke behandelingen kansrijk zijn voor individuele patiënten met gliomen.
Andere voorbeelden zijn de digitale tweeling die in staat is om met ‘s werelds meest gedetailleerde gezondheidsdatabase toekomstige ziekten te voorspellen. Het model kan jaren van tevoren risico's aan het licht brengen, preventieve strategieën testen en zelfs een gepersonaliseerd gezondheidstraject uitstippelen.